
β
一、证据水平及推荐等级
本指南参考文(wén)献来自PubMed、OVID平台数据库、Springer-Link、Elsevier Science Direct電(diàn)子期刊、中國(guó)期刊网全文(wén)数据库(CNKI)和万方数据库等数据资源。文(wén)献参照2001年英國(guó)牛津循证医學(xué)的证据分(fēn)级与推荐意见强度,将证据水平分(fēn)為(wèi)Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ共5个级别,推荐等级分(fēn)為(wèi)A、B、C和D共4个等级。本指南中以[证据水平/推荐等级]表示。
二、TDT病因和病理(lǐ)生理(lǐ)
人类β珠蛋白基因簇定位于第11号
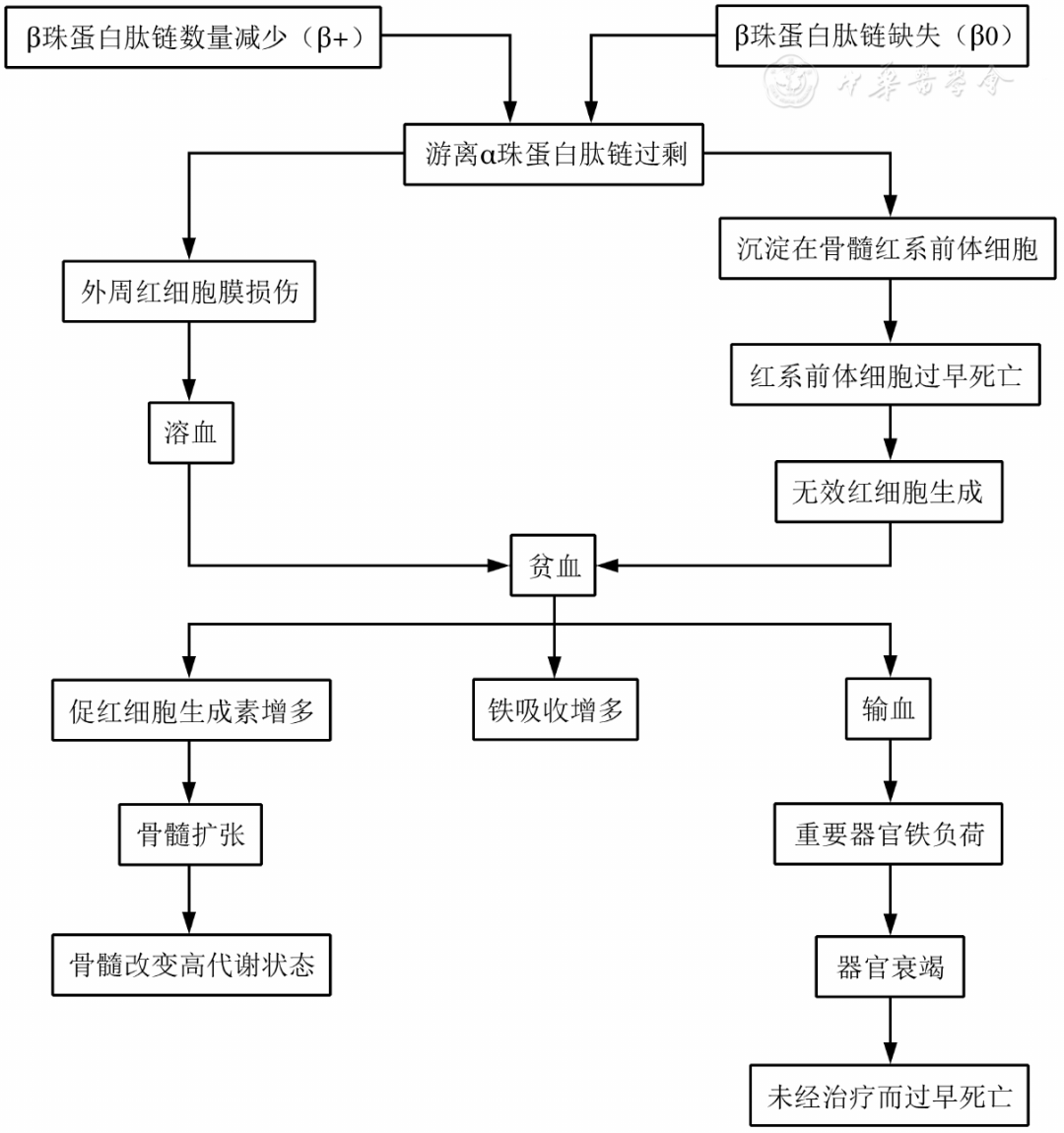
图1 β地中海贫血中游离α珠蛋白肽链过剩产生的影响
正常人自父母双方各遗传一条正常β珠蛋白基因,合成正常量的β珠蛋白肽链。若自父母遗传了异常β珠蛋白基因,则可(kě)导致本病。β地贫大部分(fēn)是点突变,少部分(fēn)為(wèi)基因缺失。基因突变致β链的生成完全受抑制者称為(wèi)β0地贫,部分(fēn)受抑制者称為(wèi)β+地贫。TDT的基因型多(duō)為(wèi)纯合子或复合杂合子状态。染色體(tǐ)上的2个等位基因都有(yǒu)相同致病突变的个體(tǐ)称為(wèi)纯合子;同源染色體(tǐ)上只有(yǒu)1个致病突变的个體(tǐ)称為(wèi)杂合子;2个等位基因的致病突变不同的个體(tǐ)称為(wèi)复合杂合子。若双亲均為(wèi)β地贫杂合子,其子女获得TDT的概率為(wèi)25%,杂合子概率為(wèi)50%,余25%為(wèi)正常。
三、TDT临床表现
临床根据贫血严重程度和是否需要定期输血将β地贫分(fēn)為(wèi)TDT和非输血依赖型β地贫(NTDT)。TDT患者需要定期输血才能(néng)存活,如果没有(yǒu)足够的输血支持会出现一系列并发症,并且生存期很(hěn)短。TDT患者包括重型β地贫、少数中间型β地贫、严重HbE/β地贫。NTDT患者包括轻型及中间型β地贫、HbE/β地贫。轻型患者一般无症状或只有(yǒu)轻度贫血,多(duō)在家系调查时被筛查发现。中间型多(duō)于幼儿期出现中度贫血,但严重度不及重型,少数中间型β地贫可(kě)进展為(wèi)TDT。重型β地贫又(yòu)称Cooley贫血,出生后3~6个月开始出现临床症状,且呈慢性进行性加重,早期症状為(wèi)食欲不佳、喂养困难、
近20年来,经推广规范的输血和祛铁治疗,大多(duō)数TDT患者不再出现本病典型特征的临床症状和體(tǐ)征,生存期明显延長(cháng),逐渐进入成年期。
四、TDT诊断
1.临床表现:
首诊时典型的临床特征。
2.血液學(xué)改变:
①外周血HGB<70 g/L,呈小(xiǎo)细胞低色素性贫血,红细胞平均容积(MCV)<80 fl、红细胞平均血红蛋白(MCH)<28 pg、红细胞平均血红蛋白浓度(MCHC)<320 g/L。红细胞形态不一、大小(xiǎo)不等、中央淡染區(qū)扩大,出现
3.血红蛋白分(fēn)析:
未启动治疗(输血)前,
4.區(qū)域及家系调查:
區(qū)域调查显示患者来自地贫高发區(qū)域。患者父母亲外周
5.基因诊断:
可(kě)采用(yòng)等位基因特异性寡核苷酸探针点杂交(PCR-ASO)、反向点杂交(RDB)和DNA测序等方法检测β地贫基因缺陷的类型。目前世界范围内已发现300多(duō)种β珠蛋白基因突变类型,中國(guó)人群中已发现50多(duō)种,目前國(guó)内实验室多(duō)应用(yòng)反向点杂交方法进行地贫的基因诊断,但该方法主要针对我國(guó)常见的珠蛋白基因突变类型进行检测。因此,临床诊断成立的TDT,且基因不是已知突变类型者,应在明确家族调查资料证实父母均為(wèi)轻型β地贫的背景下,开展基因测序。
6.诊断与鉴别诊断:
典型的TDT患者诊断并不困难。对于进行性严重贫血的患儿,有(yǒu)脾脏肿大,MCV、MCH、MCHC明显降低,网织红细胞比例增高,外周血
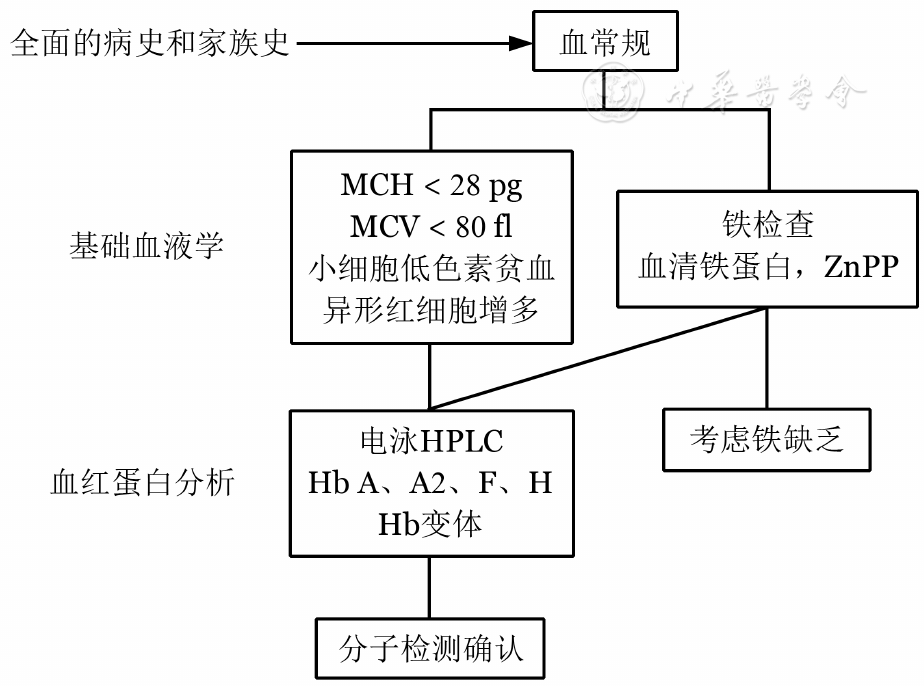
注 MCH:红细胞平均血红蛋白;MCV:红细胞平均體(tǐ)积;HPLC:高效液相色谱;ZnPP:锌原卟啉
图2 地中海贫血诊断流程图
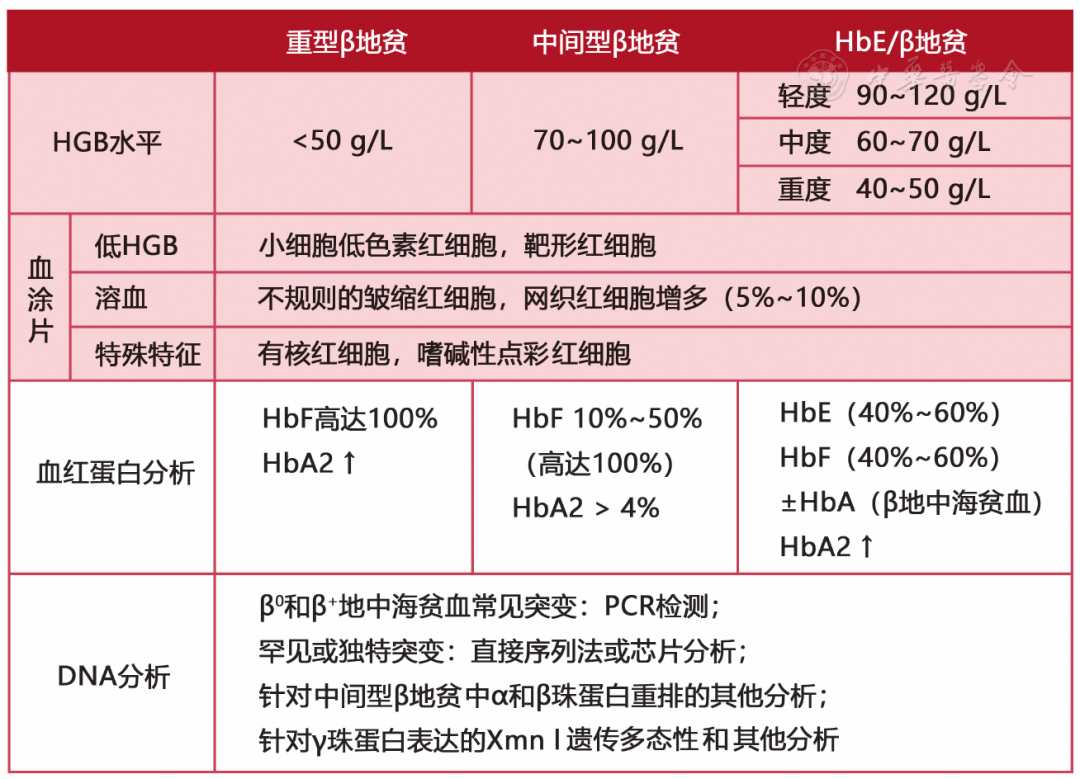
图3 地中海贫血的诊断方法总结(HbE/β地贫:血红蛋白E/β地贫)
五、TDT治疗
规范性输血和去铁治疗是维持TDT患者生存的主要方法,
(一)输血疗法
目的在于维持患者血红蛋白浓度接近正常水平,减轻代偿性骨髓增生及髓外造血,减少肠道铁吸收,防止慢性缺氧,保障患者正常生長(cháng)发育及改善生存质量的需求。
1.输血计划:
初次输血指征:(1)明确地贫诊断。(2)存在如下情况:①明显的贫血症状;②生長(cháng)发育缓慢/生長(cháng)受限;③过多(duō)髓内造血产生的并发症,如病理(lǐ)性
输血频率及目标值:(1)每2~5周输血1次,每次输红细胞0.5~1.0单位/10 kg(國(guó)内将200 ml全血中提取的红细胞定义為(wèi)1单位),输血时间根据输血反应和心功能(néng)状态调整,宜4 h内输完,但可(kě)依据实际情况适当延長(cháng);(2)维持输血前HGB水平在95~105 g/L(通常要使输血后HGB达到130~150 g/L),这可(kě)保障正常生長(cháng)发育及體(tǐ)育活动;(3)维持输血前HGB在110~120 g/L,更适合于
2.血液制品的选择[Ⅱ/B]:
(1)选择ABO及Rh(D)血型相同的红细胞制品,有(yǒu)条件时还可(kě)选择与抗原C、E及Kell(Mur)相匹配的红细胞制品;(2)推荐使用(yòng)去白细胞悬浮红细胞;(3)对合并
(二)祛铁治疗
1.铁过载评估:
TDT患者因長(cháng)期反复输血,以及長(cháng)期贫血,肠道铁吸收过多(duō)导致继发性铁过载,是地贫常见并发症。目前评估铁过载状况的方法主要有(yǒu):血清铁蛋白(SF)、肝铁浓度(LIC)及心铁浓度(MIC)等。
SF检测是反映机體(tǐ)铁过载状况最简单实用(yòng)的方法,SF升高提示铁负荷增加,但需排除感染、肝功能(néng)损害、肿瘤、溶血、酗酒等因素影响。建议每3~6个月动态检测SF 1次[Ⅴ/D]。
近年,MRI已广泛应用(yòng)于评估地贫患者體(tǐ)内脏器铁过载情况。肝脏MRI T2*可(kě)反映肝脏铁负荷情况,并与LIC检测存在相关性:LIC 3~7 mg Fe/g干重提示轻度铁过载;7~15 mg Fe/g干重提示中度铁过载;>15 mg Fe/g干重提示重度铁过载[Ⅰ/A]。LIC需每1~2年评估1次[Ⅴ/D]。MIC目前常用(yòng)心脏MRI T2*值评估:T2*<10 ms提示患者心脏有(yǒu)重度铁过载,建议每3个月复查1次;T2*值位于10~20 ms,提示患者心脏有(yǒu)轻至中度铁过载,建议每年复查1次;T2*>20 ms提示患者心脏暂无明显铁过载,可(kě)每2年复查1次[Ⅱ/B]。
肝穿刺
2.祛铁治疗的时机:
(1)输血次数≥10次;(2)在排除活动性炎症、肝病、肿瘤、溶血、酗酒等因素影响后,SF >1000 μg/L或LIC ≥5 mg Fe/g干重。祛铁治疗后每3~6个月监测SF或MRI,当SF <500 μg/L或LIC <5 mg Fe/g干重可(kě)暂停使用(yòng)铁螯合剂[Ⅴ/D]。
在3岁前开展祛铁治疗,要特别监测生長(cháng)和骨骼发育情况,并且减少剂量。
3.祛铁治疗策略:
祛铁药物(wù)及其选择:目前临床上应用(yòng)的铁螯合剂主要包括去铁胺(DFO)、去铁酮(DFP)和
(1)DFO:DFO代謝(xiè)半衰期為(wèi)20~30 min,代謝(xiè)后主要通过尿液排出。DFO為(wèi)大分(fēn)子物(wù)质,肠道无法吸收。
用(yòng)药方法:①将DFO配成10%的浓度,推荐采用(yòng)输液泵持续皮下注射,每次输注时间8~12 h[Ⅰ/A]。②儿童标准剂量為(wèi)20~40 mg·kg-1·d-1,成人剂量可(kě)高达50~60 mg·kg-1·d-1,每周连续应用(yòng)5~7 d[Ⅰ/A]。③
治疗指数(毒性指数)=平均每日DFO剂量(mg/kg)/血清铁蛋白(μg/L)。应保持治疗指数<0.025,以减少DFO的不良反应[Ⅰ/A]。建议每年使用(yòng)DFO至少225 d[Ⅱ/B]。
注意事项及不良反应:①用(yòng)药前后应监测血清铁蛋白。②皮下注射部位首选腹部,每天应更换腹部注射部位,以助药物(wù)吸收。③维生素C可(kě)动员铁及氧化代謝(xiè)并间接影响心肌细胞,在重度铁过载时不宜使用(yòng)大剂量维生素C;停用(yòng)DFO期间也应停止服用(yòng)维生素C[Ⅱ/B]。④DFO偶见过敏反应,長(cháng)期使用(yòng)偶可(kě)致
(2)DFP:DFP是口服铁鳌合剂,代謝(xiè)半衰期為(wèi)3~4 h,主要经尿液排出。研究表明DFP对心脏铁过载有(yǒu)较强的治疗作用(yòng)[Ⅰ/A]。
用(yòng)药方法:①标准剂量為(wèi)75 mg·kg-1·d-1,分(fēn)3次口服,最大剂量不超过100 mg·kg-1·d-1[Ⅰ/A]。②适用(yòng)于6岁以上的患儿。
注意事项及不良反应:①目前维生素C在DFP治疗中的联合作用(yòng)尚未明确,不推荐联合应用(yòng)。②DFP常见的不良反应是关节痛(主要是大关节)、一过性的
(3)DFX:DFX為(wèi)口服铁螯合剂,代謝(xiè)半衰期8~16 h,主要经粪便排出。用(yòng)药方法:①DFX常用(yòng)剂量為(wèi)20~40 mg·kg-1·d-1。②适用(yòng)于2岁以上的患儿,每日1次,餐前口服。
注意事项及不良反应:①DFX可(kě)引起胃肠道反应、
(4)联合用(yòng)药:单独应用(yòng)铁螯合剂而祛铁疗效不佳,可(kě)予2种铁螯合剂联合应用(yòng)。联合策略包括应用(yòng)DFO和DFP、DFP和DFX、DFO和DFX。TDT合并
(5)祛铁治疗方案见图4。
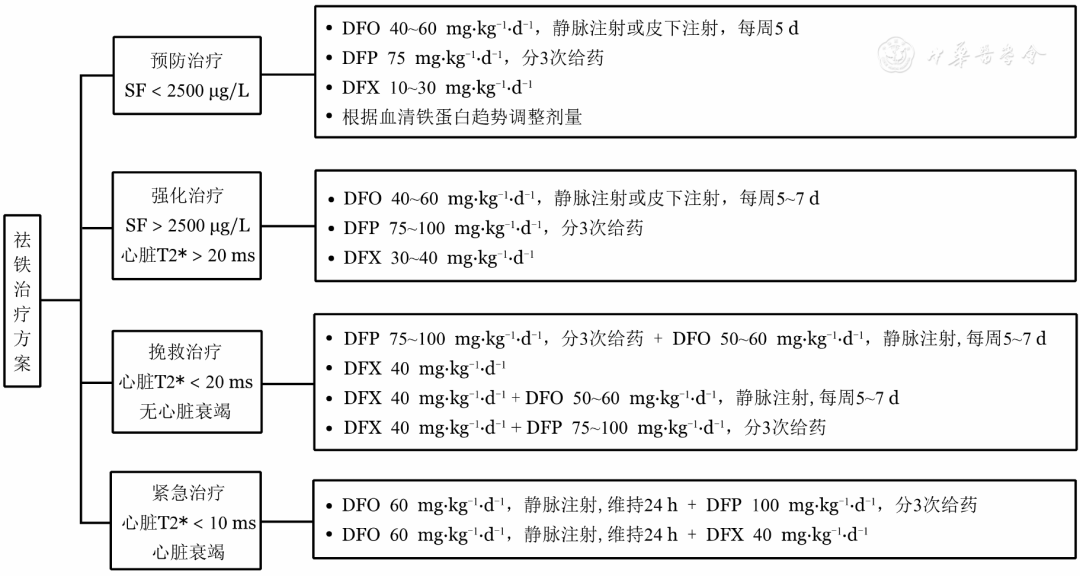
注 SF:血清铁蛋白;DFO:去铁胺;DFP:去铁酮;DFX:地拉罗司
图4 地中海贫血患者祛铁治疗方案
(三)改善无效造血
罗特西普(luspatercept)是一种晚期红细胞成熟剂,可(kě)促进β地贫患者骨髓内幼红细胞向晚期红细胞分(fēn)化成熟,适用(yòng)于治疗需要定期输注红细胞且红细胞输注≤15单位/24周的≥18岁β地贫成人患者(境外临床研究中1单位红细胞指200~350 ml浓缩红细胞,应根据中國(guó)的临床实践进行换算);推荐起始剂量為(wèi)1.0 mg/kg,皮下注射,每3周1次;以1.0 mg/kg起始剂量至少连续给药2次(6周)后未达到红细胞输注负荷降低,则应将剂量增加至1.25 mg/kg。最大治疗剂量不应超过每3周1.25 mg/kg[Ⅰ/A]。罗特西普常见不良事件包括一过性骨痛、关节痛、
(四)HSCT
HSCT是目前根治TDT的唯一方法。我國(guó)主要地贫移植中心的地贫移植无地贫生存(TFS)率达90%以上,是TDT治疗的最佳选择。根据供者来源、人类白细胞抗原(HLA)不同,地贫移植分(fēn)為(wèi)HLA全相合同胞供者移植(MSD-HSCT)、非血缘供者移植(UD-HSCT)和HLA单倍體(tǐ)移植(Haplo-HSCT);根据干细胞来源分(fēn)為(wèi)骨髓移植(BMT)、外周血干细胞移植(PBSCT)和脐带血移植(UCBT)。
1.移植前危险度评估及移植时机:
既往國(guó)际多(duō)采用(yòng)Pesaro评分(fēn),根据有(yǒu)无肝肿大(肋缘下≤ 2 cm)、肝纤维化和铁螯合剂是否规则应用(yòng)分(fēn)成三个危险度。我國(guó)重型地贫患者绝大多(duō)数属于Ⅱ度及以上,少有(yǒu)Ⅰ度。因肝活检為(wèi)侵入性操作,故Pesaro分(fēn)级方案在我國(guó)的临床应用(yòng)有(yǒu)一定的局限性。因此移植前规则输血及规则祛铁治疗尤為(wèi)关键。HSCT最佳年龄為(wèi)2~7岁,年龄≥16岁是移植的高危因素[Ⅰ/A];此外,患者年龄≥7岁同时伴肝右肋缘下≥5 cm也是移植的高危因素,移植相关死亡率增加。对有(yǒu)HLA全相合供者、年龄16岁以下、器官功能(néng)正常、没有(yǒu)严重感染的TDT患者,宜尽快考虑移植。
2.移植供者及干细胞选择:
(1)人类白细胞抗原(HLA)配型选择供者:选择顺序是HLA全相合同胞供者➝非血缘HLA全相合供者➝单倍體(tǐ)供者。有(yǒu)经验的HSCT中心可(kě)考虑进行非血缘或单倍體(tǐ)HSCT。HLA全相合同胞BMT和PBSCT植入率高,而UCBT则应保证一定阈值的单个核细胞数(MNC)和CD34+细胞数[Ⅱ/B]。(2)不同移植方式的MNC和CD34+细胞阈值推荐:BMT时要求MNC為(wèi)(2~4)×108/kg,CD34+细胞為(wèi)(2~4)×106/kg;PBSCT时MNC≥ 4×108/kg,CD34+细胞≥ 4×106/kg;UBCT时MNC≥ 3.7×107/kg,CD34+细胞≥ 2.3×105/kg,方才有(yǒu)利于植入[Ⅴ/D]。
3.移植预处理(lǐ)方案:
经典清髓方案為(wèi)
4.GVHD的预防方案:
HLA全相合同胞供者移植建议采用(yòng)环孢素(CsA)+短程甲氨蝶呤(MTX)+霉酚酸酯(MMF)方案;术后维持CsA血药浓度(200±50) mg/L,如无GVHD表现,移植术后12个月起缓慢减量,至术后18个月停用(yòng),取得很(hěn)好的临床效果,无关供者移植和单倍體(tǐ)移植建议选择他(tā)克莫司(FK506)+MTX+MMF方案或选择PTCY方案[Ⅲ/B]。FK506的目标谷浓度范围為(wèi)(10±5) μg/L。
5.肝静脉闭塞病(VOD)的防治方案:
地贫患者因肝铁过载等原因,VOD发生率高达10%,应十分(fēn)注意VOD的预防、早期诊断及治疗。VOD预防可(kě)采用(yòng)
6.移植后嵌合状态:
移植后监测供者植入百分(fēn)比对预测移植排斥或移植失败有(yǒu)重要的临床意义。移植后嵌合状态分(fēn)3个水平:嵌合程度1(受者细胞百分(fēn)比<10%),嵌合程度2(受者细胞百分(fēn)比占10%~25%),嵌合程度3(受者细胞百分(fēn)比>25%)。宿主残余造血干细胞比例升高会增加移植物(wù)排斥风险,当出现嵌合程度3时,患者存在较高移植物(wù)排斥风险。对嵌合程度1患者,应严密观察;对嵌合程度2患者,可(kě)减停免疫抑制药物(wù);对嵌合程度3患者,可(kě)应用(yòng)供者淋巴细胞或供者干细胞输注,建议造血干细胞植入后3个月内每周监测嵌合状态,以后可(kě)每1~3个月进行监测,直到移植后2年[Ⅱ/B]。
(五)脾切除
脾切除术為(wèi)治疗TDT患者的姑息手段,脾切除的指征為(wèi):(1)依赖输血量明显增多(duō),如维持HGB 90~105 g/L,每年红细胞输注量>200 ml/kg者,且经规则祛铁治疗而铁负荷仍增加[Ⅱ/B]。(2)脾功能(néng)亢进者,患者出现红细胞破坏增加,持续的白细胞减少或血小(xiǎo)板减少,临床上出现反复感染或出血。(3)脾脏增大并有(yǒu)伴随症状者,如患者出现明显左上腹疼痛或易饱感,巨脾引起压迫及脾破裂等可(kě)能(néng)。符合以上指征之一可(kě)行脾切除术,建议行脾切除术时患者年龄≥5岁,5岁以下进行脾切除会增加严重
全脾切除的外科(kē)手术有(yǒu)开腹和
(六)基因治疗
地贫是单基因遗传性疾病,是基因治疗的理(lǐ)想对象。目前β地贫的基因治疗可(kě)分(fēn)為(wèi)基因替代疗法和基因编辑疗法两种。基因替代疗法是采用(yòng)慢病毒载體(tǐ)将正确的β珠蛋白基因导入患者造血干细胞,并回输给患者,达到提升β珠蛋白表达,促使Hb A生成的目标。此类代表性药物(wù)是美國(guó)蓝鸟生物(wù)公司的"LentiGlobin"(Zynteglo),于2019年在欧洲有(yǒu)条件批准上市。基因编辑疗法是通过抑制γ珠蛋白基因簇的调控因子BCL11A从而提高γ珠蛋白基因表达。通过CRISPR基因编辑BCL11A,以提升γ珠蛋白基因表达,改善患者贫血状况。瑞士CRISPR Therapeutics公司于2018年8月31日启动了全球首个基于CRISPR基因编辑技术提高γ珠蛋白表达的临床试验,受试患者平均随访8.7个月,绝大部分(fēn)患者的Hb F表达显著提高,部分(fēn)患者的总HGB量大于100 g/L。國(guó)内多(duō)家医疗机构先后利用(yòng)CRISPR-Cas9技术靶向γ珠蛋白编辑靶点,进行了基因编辑治疗TDT患者的临床研究,均已取得初步成效,共完成10余例TDT基因治疗,患者Hb F在移植后1个月开始出现显著上升,使部分(fēn)TDT患者摆脱输血依赖,研究随访仍在进行中。然而,目前基因治疗临床经验有(yǒu)限,需要更多(duō)的临床数据和大规模试验来证明基因治疗是一种安全和治愈性的治疗方法。
(七)探索性治疗
近10年来,随着对
六、TDT的预防
TDT危害大,临床治疗成本高,效果仍不理(lǐ)想。因此,预防控制显得尤為(wèi)重要。预防控制的主要措施包括社區(qū)筛查、遗传咨询和产前诊断。对于有(yǒu)TDT患儿出生史、夫妻均為(wèi)地贫携带者的高危孕妇应严格进行产前诊断。产前诊断包括取胎儿绒毛、羊水及胎儿脐带血作基因分(fēn)析。其中以早期绒毛為(wèi)首选,取胎儿绒毛以孕8~12周為(wèi)最佳时间;若错过采集绒毛的时机,可(kě)于孕16~24周采集羊水,并经培养去除母血细胞后提取胎儿DNA进行基因分(fēn)析;经胎儿脐静脉穿刺取血样提取胎儿DNA也可(kě)以用(yòng)于产前诊断,一般在孕20~26周进行。但上述均為(wèi)侵入性产前诊断途径,存在一定风险。近年来逐渐发展了一种非损伤性、非侵入性产前诊断方法,即从孕妇外周血中提取胎儿DNA用(yòng)于基因分(fēn)析。产前诊断是预防与监控的结果,具有(yǒu)很(hěn)强的社会意义和实用(yòng)价值,特别是在地贫高发區(qū),是预防地贫的关键。
本文(wén)摘自中华医學(xué)会血液學(xué)分(fēn)会红细胞疾病(贫血)學(xué)组. 中國(guó)输血依赖型β地中海贫血诊断与治疗指南(2022年版) [J] . 中华血液學(xué)杂志(zhì), 2022, 43(11) : 889-896. DOI: 10.3760/cma.j.issn.0253-2727.2022.11.002.如遇版权问题请联系删除。
上一篇::地中海贫血症状
下一篇::没有(yǒu)了